Der erste selektive IL-23-Inhibitor, der sowohl bei Morbus Crohn als auch Colitis ulcerosa zugelassen ist.
Herzlich Willkommen bei SKYRIZI®
Skyrizi wird angewendet zur Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer aktiver Colitis ulcerosa, die auf eine konventionelle Therapie oder eine Biologikatherapie unzureichend angesprochen, diese nicht vertragen haben oder nicht mehr darauf ansprechen.
(siehe Fachinformation Skyrizi®, Stand Juli 2024)
Mukosale Heilung1,3
Definiert als endoskopischer Subscore ≤1 ohne den Nachweis einer Friabilität.
Zusätzlicher vordefinierter Endpunkt, der nicht auf Multiplizität kontrolliert wurde.
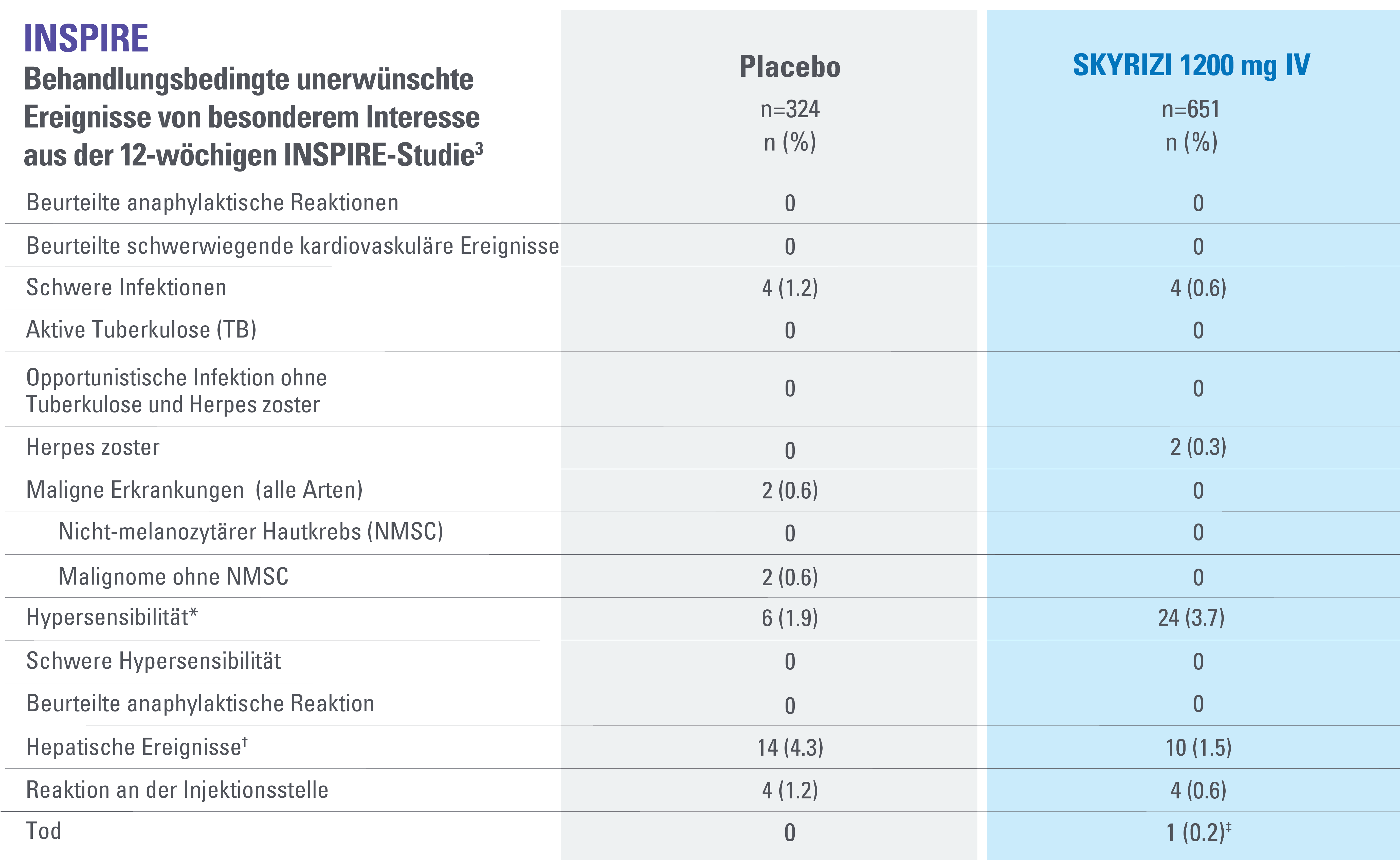
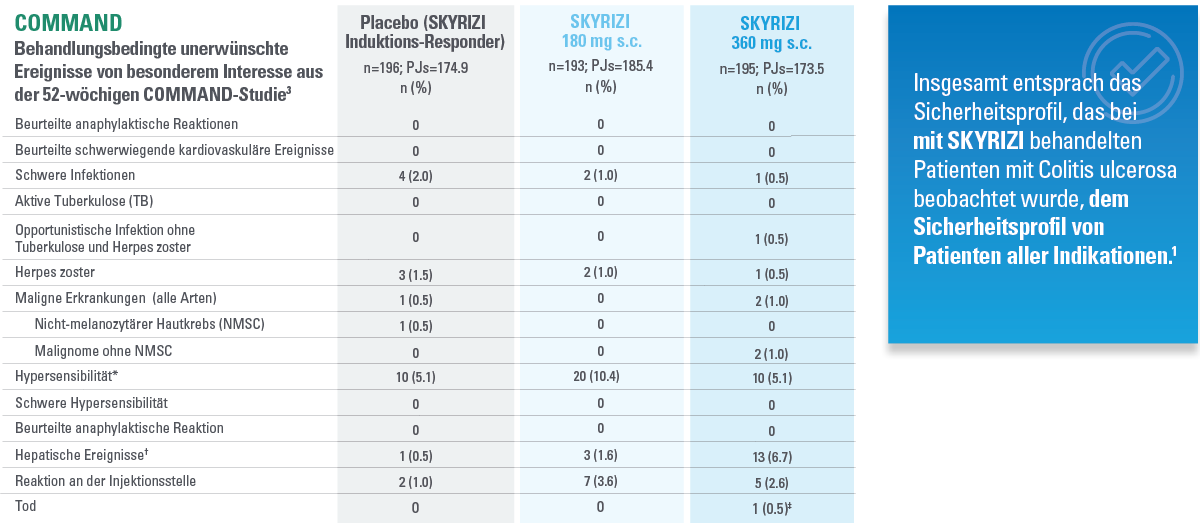
DATENBESCHRÄNKUNGEN: Daten, die nicht als primärer oder sekundärer Endpunkt gekennzeichnet sind, wurden vorab zwar angegeben, aber sie wurden nicht auf Multiplizität eingestuft oder kontrolliert.
Daher könnten Behandlungsunterschiede Zufallsbefunde darstellen. Aus diesen Vergleichen lassen sich keine Rückschlüsse ziehen. Fehlerbalken stellen ein Konfidenzintervall von 95 % dar.3
Non-advanced therapy-inadequate responder (Probanden ohne Biologika- und/oder JAK-Inhibitor-Versagen) sind definiert als Probanden, bei denen eine oder mehrere
Biologika-Therapien, JAK-Inhibitoren und/oder S1P-Rezeptor-Modulatoren nicht versagt haben (unzureichendes Ansprechen oder Intoleranz).
Mukosale Heilung1,3
Endoskopische Verbesserung definiert als endoskopischer Subscore 0 oder 1 ohne Friabilität
Zusätzlicher vordefinierter Endpunkt, der nicht auf Multiplizität kontrolliert wird.
DATENBESCHRÄNKUNGEN: Daten, die nicht als primärer oder sekundärer Endpunkt gekennzeichnet sind, wurden vorab zwar angegeben, aber sie wurden nicht auf Multiplizität eingestuft oder kontrolliert.
Daher könnten Behandlungsunterschiede Zufallsbefunde darstellen. Aus diesen Vergleichen lassen sich keine Rückschlüsse ziehen. Fehlerbalken stellen ein Konfidenzintervall von 95 % dar.3
Advanced therapy-inadequate responders (Patienten mit Biologika- und/oder JAK-Inhibitorversagen) sind definiert als Probanden, bei denen eine oder mehrere Biologika-Therapien, JAK-Inhibitoren und/oder S1P-Rezeptormodulatoren versagt haben (unzureichendes Ansprechen oder Unverträglichkeit).
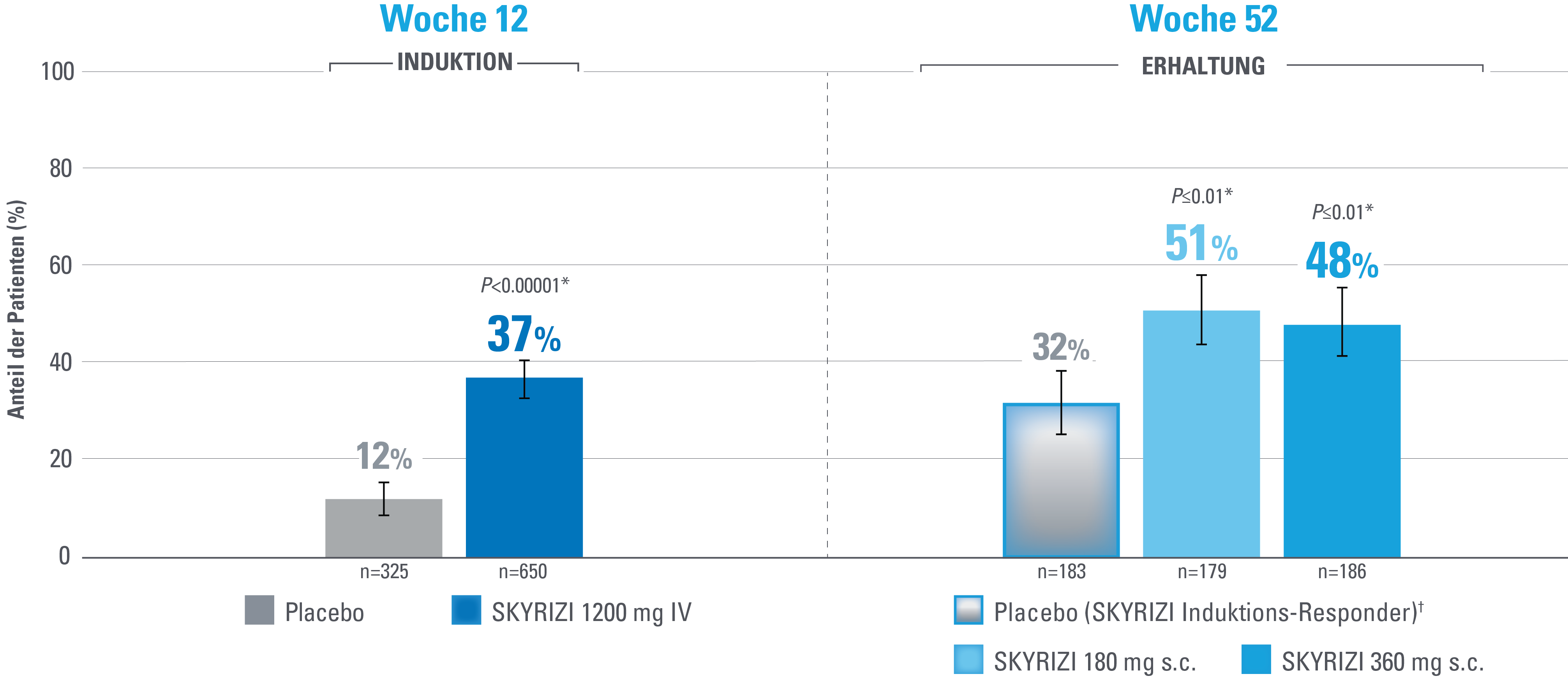
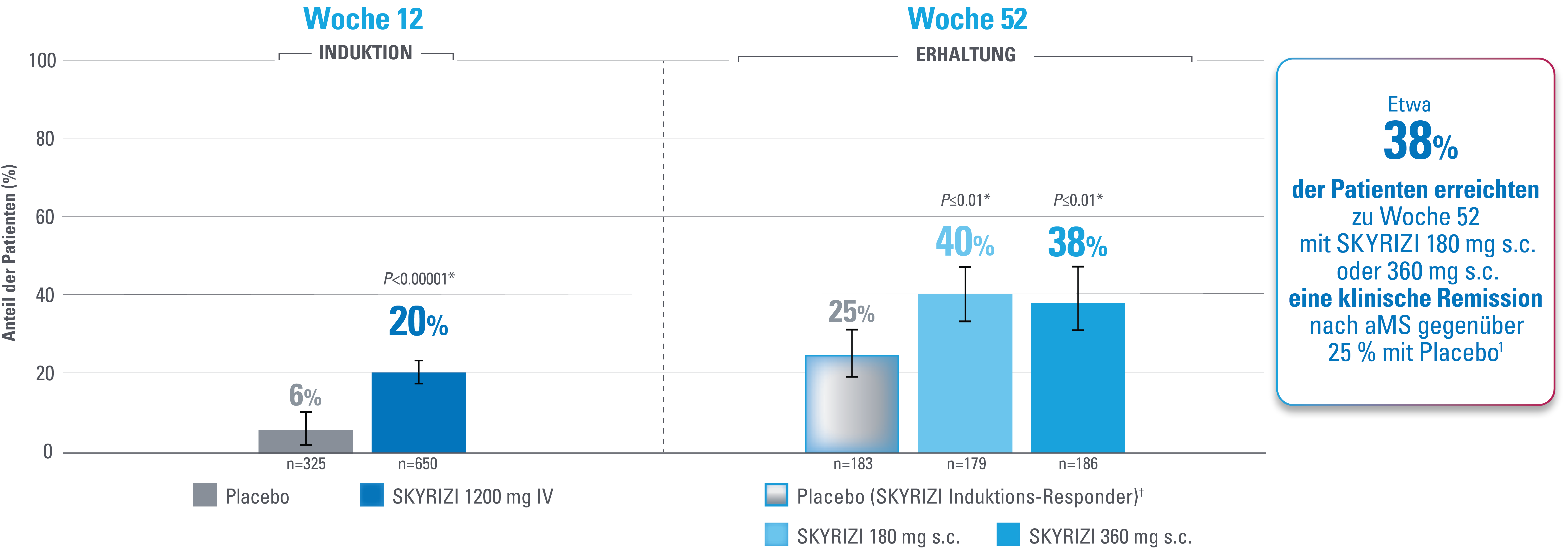
Klinische Remission nach angepasstem Mayo-Score (aMS)1,3
Zusammensetzung aus rektalem Blutungs-Subscore (RBS), Stuhlfrequenz-Subscore (SFS) und endoskopischem Subscore (ES)
Fehlerbalken stellen ein Konfidenzintervall von 95 % dar.3
*Statistisch signifikant unter Multiplizitätskontrolle für den Vergleich von SKYRIZI und Placebo.1,3
Definition des Endpunkts
Die klinische Remission nach mMS ist definiert als SFS ≤1 und nicht größer als der Ausgangswert, RBS=0 und ES ≤1 ohne Anzeichen einer Friabilität.1
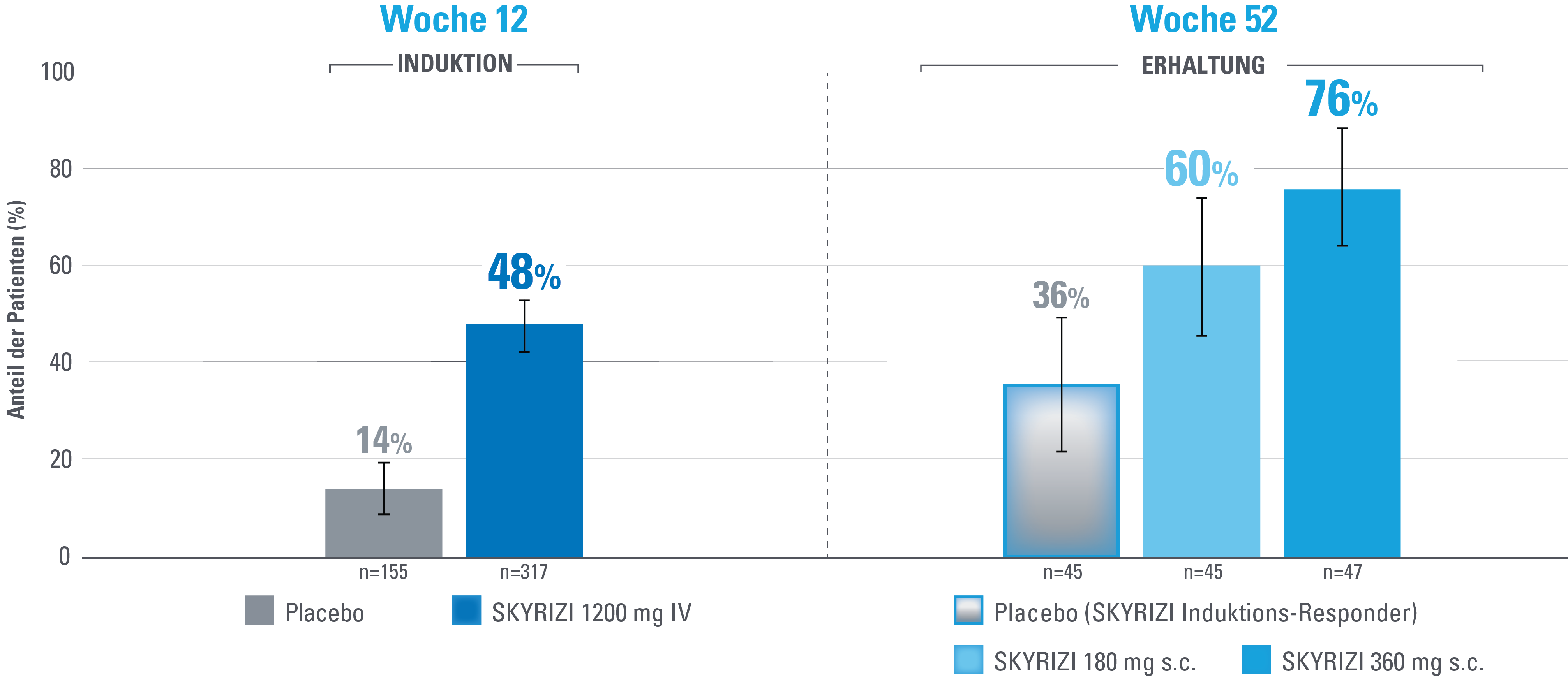
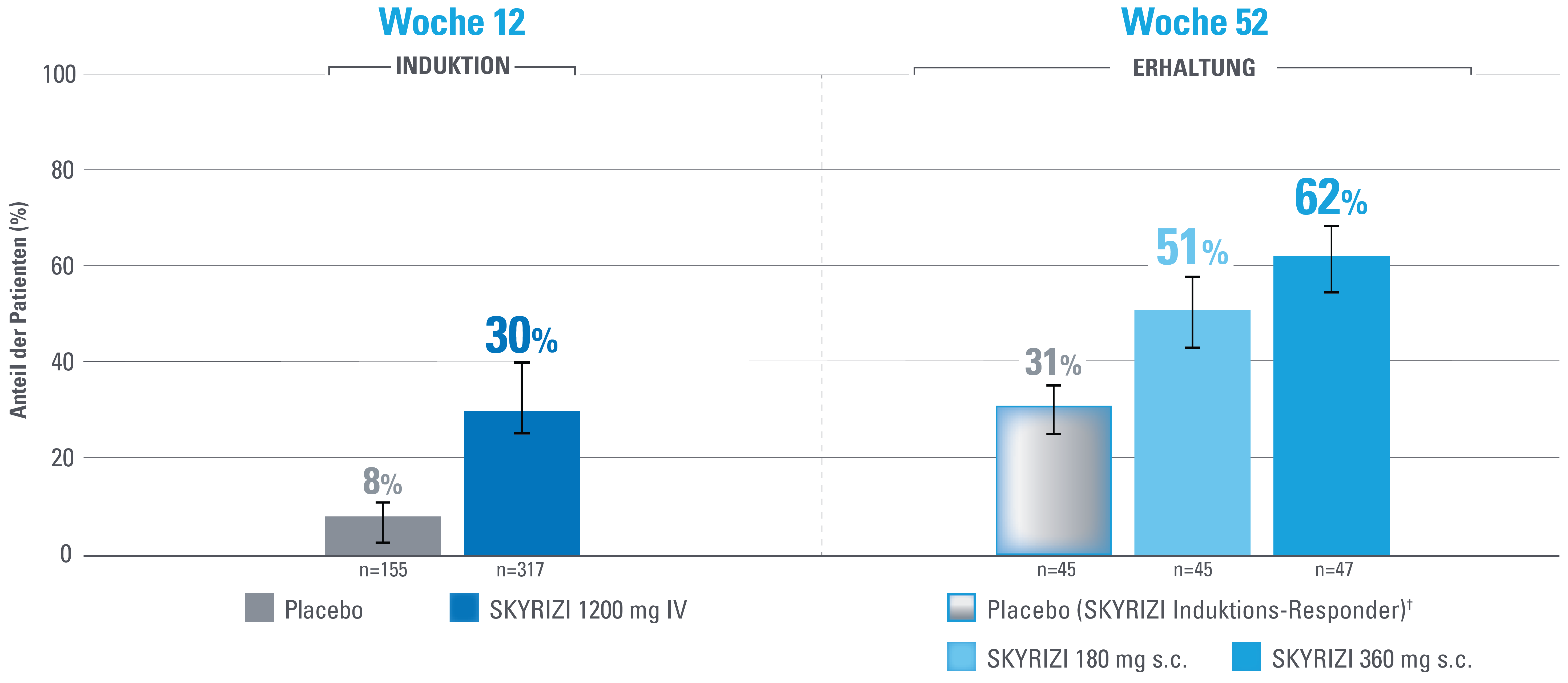
Klinische Remission nach angepasstem Mayo-Score (aMS)1,3
Zusätzlicher vordefinierter Endpunkt, der nicht auf Multiplizität kontrolliert wird.
DATENBESCHRÄNKUNGEN: Daten, die nicht als primärer oder sekundärer Endpunkt gekennzeichnet sind, wurden vorab zwar angegeben, aber sie wurden nicht auf Multiplizität eingestuft oder kontrolliert.
Daher könnten Behandlungsunterschiede Zufallsbefunde darstellen. Es können keine Schlussfolgerungen in Bezug auf diese Vergleiche angestellt werden.
Fehlerbalken stellen ein Konfidenzintervall von 95 % dar.3
Non-advanced therapy-inadequate responder (Probanden ohne Biologika- und/oder JAK-Inhibitorversagen) sind definiert als Probanden, bei denen eine oder mehrere Biologika-Therapien, JAK-Inhibitoren und/oder S1P-Rezeptor-Modulatoren nicht fehlgeschlagen haben.
Definition des Endpunkts:
Die klinische Remission nach aMS ist definiert als Stuhlfrequenz-Score (SFS) ≤1 und nicht größer als der Ausgangswert, rektaler Blutungs-Subscore (RBS)=0 und endoskopischer Score ≤1 ohne Hinweise auf Friabilität.1
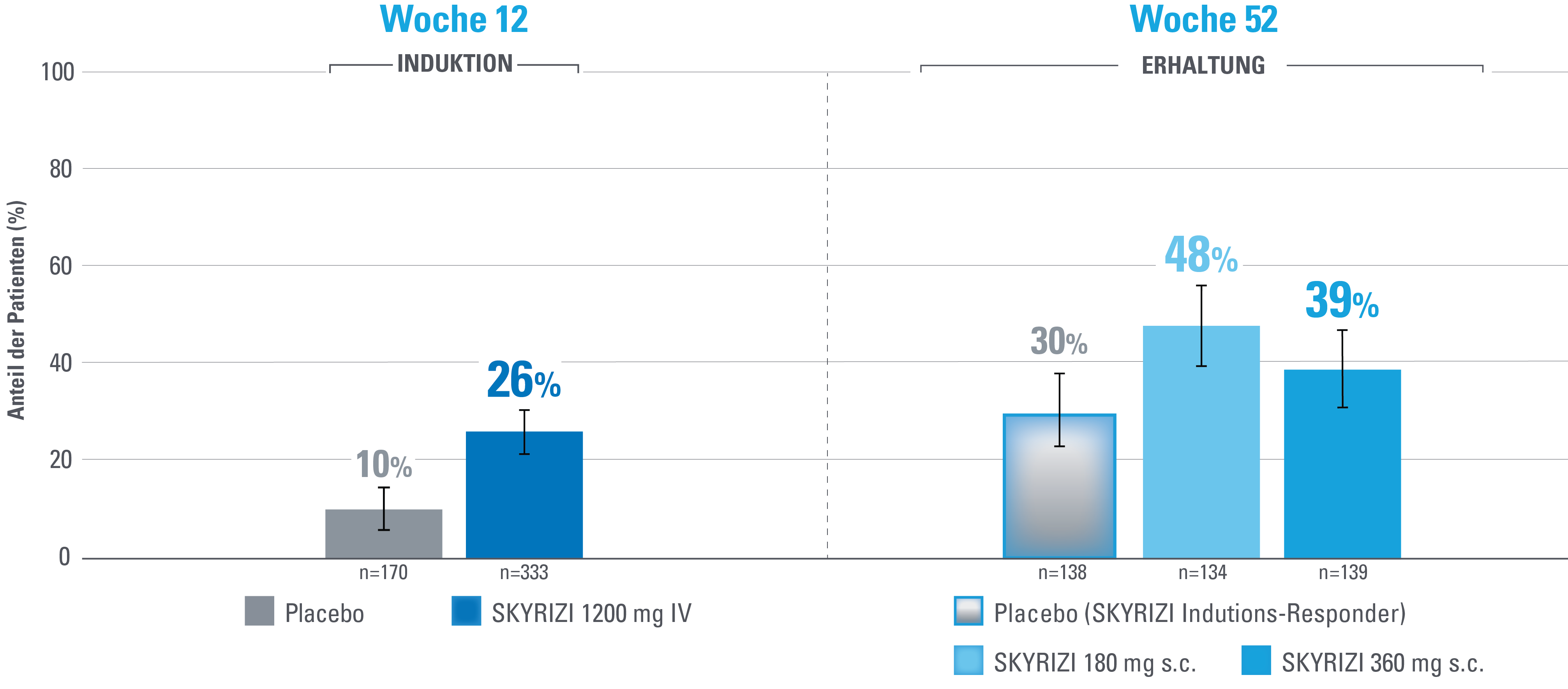
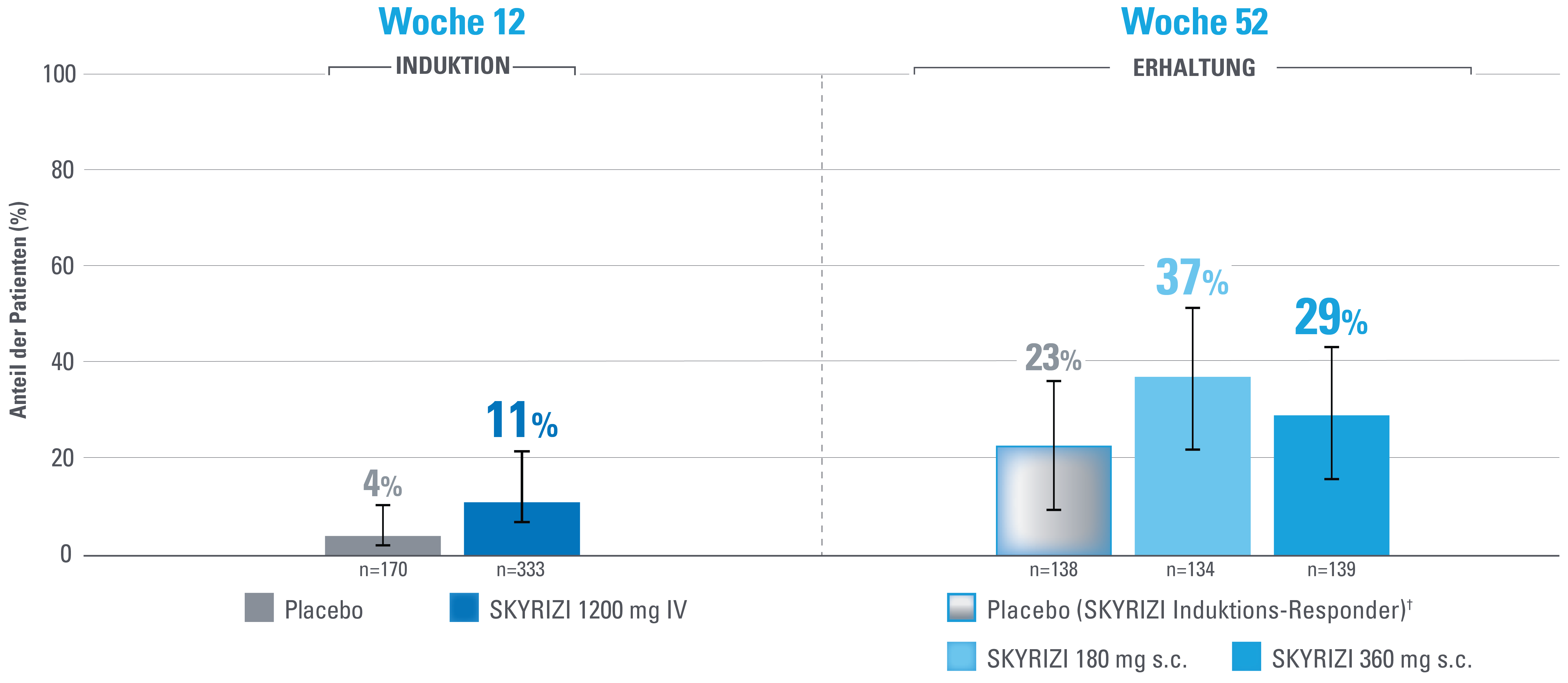
Klinische Remission nach angepasstem Mayo-Score (aMS)1,3
Zusätzlicher vordefinierter Endpunkt, der nicht auf Multiplizität kontrolliert wird.
DATENBESCHRÄNKUNGEN: Daten, die nicht als primärer oder sekundärer Endpunkt gekennzeichnet sind, wurden vorab zwar angegeben, aber sie wurden nicht auf Multiplizität eingestuft oder kontrolliert.
Daher könnten Behandlungsunterschiede Zufallsbefunde darstellen. Es können keine Schlussfolgerungen in Bezug auf diese Vergleiche angestellt werden.
Fehlerbalken stellen ein Konfidenzintervall von 95 % dar.3
Advanced therapy-inadequate responders (Patienten mit Biologika- und/oder JAK-Inhibitorversagen) sind definiert als Probanden, bei denen eine oder mehrere Biologika-Therapien, JAK-Inhibitoren und/oder S1P-Rezeptormodulatoren versagt haben (unzureichendes Ansprechen oder Unverträglichkeit).
Definition des Endpunkts:
Die klinische Remission nach aMS ist definiert als Stuhlfrequenz-Score (SFS) ≤1 und nicht größer als der Ausgangswert, rektaler Blutungs-Subscore (RBS)=0 und endoskopischer Score ≤1 ohne Hinweise auf Friabilität.1
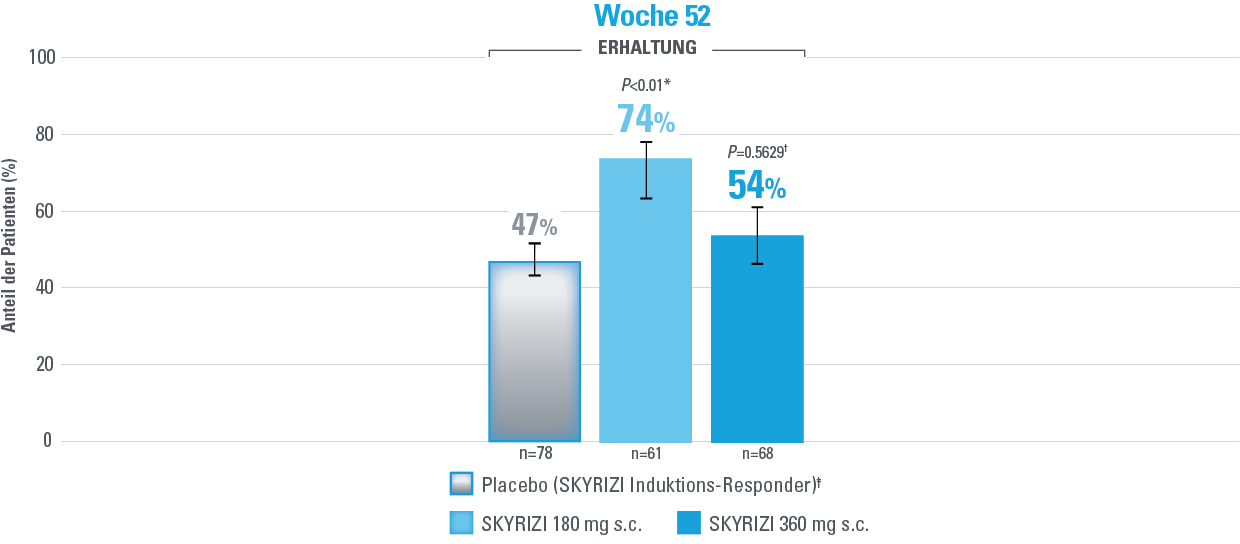
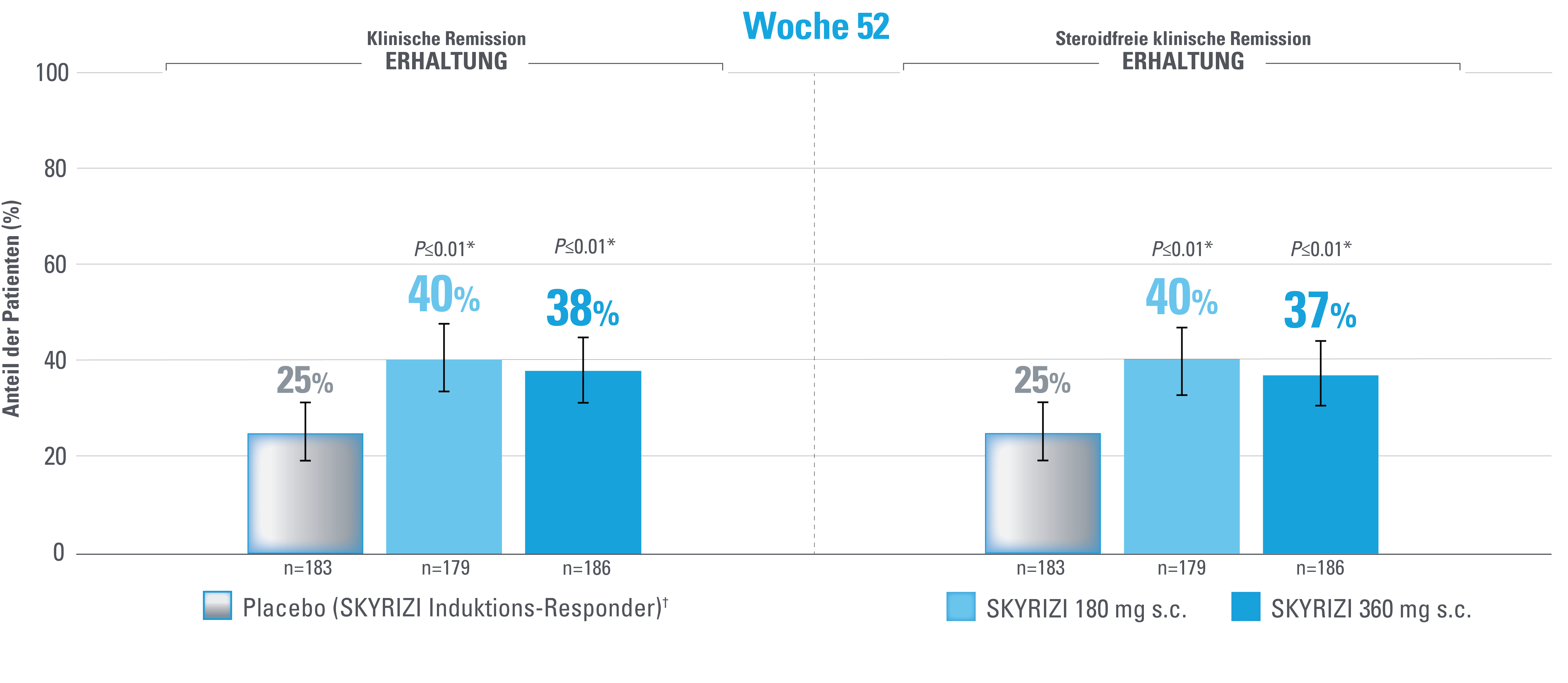
Klinische Remission und steroidfreie klinische Remission nach angepasstem Mayo-Score (aMS)1,3
Fehlerbalken stellen ein Konfidenzintervall von 95% dar.3
*Statistisch signifikant unter Multiplizitätskontrolle für den Vergleich von SKYRIZI und Placebo.1,3
Definition des Endpunkts:
Die klinische Remission nach aMS ist definiert als ein Subscore für die Stuhlfrequenz (SFS) ≤1 und nicht größer als der Ausgangswert, der Subscore für rektale Blutungen (RBS)=0 und der endoskopische Subscore ≤1 ohne Anzeichen einer Friabilität.1
Eine steroidfreie klinische Remission ist definiert als klinische Remission nach aMS zu Woche 52 und kortikosteroidfrei für ≥90 Tage.1
1 Skyrizi Fachinformation, Stand: 07/2024
2 Data on file. ABVRRTI78474
3 Louis E et al., Risankizumab for Ulcerative Colitis: Two Randomized Clinical Trials. JAMA. Published online July 22, 2024.doi:10.1001/jama.2024.12414.
4 Data on file. ABVRRTI77562.
AT-SKZG-230040-26082024